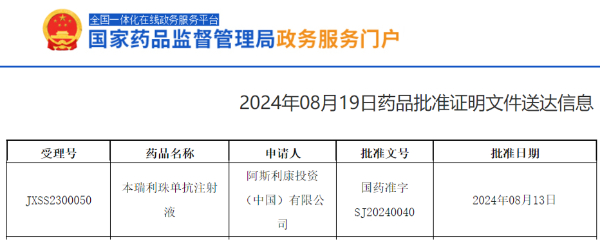
8月20日,阿斯利康宣布,凡舒卓(通用名:本瑞利珠单抗注射液)已获得中国国家药品监督管理局正式批准,用于成人和12岁及以上青少年重度嗜酸粒细胞性哮喘(SEA)的维持治疗。
本次获批是基于III期临床试验MIRACLE研究的积极结果,这项研究于中国、韩国以及菲律宾开展。研究显示,接受标准治疗的重度嗜酸粒细胞性哮喘患者,在使用本瑞利珠单抗治疗后,其年急性发作率(AAER)显著降低达74% (本瑞利珠单抗治疗组0.49,安慰剂组1.88,风险比0.26,p<0.0001), 具有显著统计学意义和临床意义。本瑞利珠单抗达到所有主要研究终点和关键次要研究终点,有助于改善肺功能和哮喘症状。
重度嗜酸粒细胞性哮喘在中国发病率高,治疗选择却十分有限,且重度哮喘被误诊和未充分治疗的情况仍然经常出现。由于频繁的急性发作、肺功能严重受限以及生活质量的下降,患者面临沉重的疾病负担。同时,重度哮喘患者死亡风险更高,且哮喘相关住院风险是持续性哮喘患者的2倍。此外,重度哮喘相关医疗费用约占哮喘患者医疗总成本的50%,为社会带来沉重的经济负担。
MIRACLE研究的国际协调研究者、中国工程院院士钟南山表示:“哮喘是一种慢性气道炎症性疾病,ICS-LABA足剂量足疗程是基石;随着生物靶向治疗时代的到来,重度哮喘患者正确的诊断分型是关键。EOS型是重度哮喘患者最常见生物表型,当前中国已有多个EOS靶向治疗的临床研究正在开展。其中,MIRACLE试验结果显示,对于我国重度嗜酸粒细胞性哮喘患者,抗IL-5受体单抗可以快速并持久控制哮喘症状,显著降低年急性发作率。研究也显示,其在中、高剂量ICS/LABA控制不佳的哮喘人群中应用疗效显著。”
阿斯利康全球执行副总裁,生物制药事业部负责人Ruud Dobber表示:“重度哮喘困扰着中国数百万患者,本瑞利珠单抗的在华获批是中国重度哮喘治疗的重要进展。中国患者将很快得以使用这一能够精准靶向EOS的创新生物制剂,显著降低急性发作风险,为中国重度哮喘患者带来显著的临床获益。”
阿斯利康全球高级副总裁、全球研发中国中心总裁何静博士表示:“MIRACLE III 期试验的研究结果全面证实,抗IL-5受体单抗本瑞利珠单抗对于治疗重度嗜酸粒细胞性哮喘具备良好的临床疗效并且易于使用。未来,我们将继续依托阿斯利康强大的研发优势,带来更多具有突破性意义的创新疗法,造福广大中国患者。”
阿斯利康中国生物制药业务总经理、香港及澳门地区负责人林骁表示:“创新生物制剂在慢性呼吸系统疾病治疗领域已展现出巨大潜力。本瑞利珠单抗的在华获批,为中国重度哮喘患者提供了新的治疗选择。以慢性呼吸系统疾病为代表,中国拥有基数极庞大的慢病患者人群,存在着广泛的健康需求。阿斯利康还将持续聚焦慢病领域创新药的加速引进,并与合作伙伴持续打造慢病管理创新‘生态圈’以造福患者。”
本瑞利珠单抗在MIRACLE研究中所显示的安全性和耐受性与其目前已知的药物特性一致。
截至目前,本瑞利珠单抗已在包括美国、日本和欧盟在内的80多个国家和地区获批用于重度嗜酸粒细胞性哮喘的联合维持治疗,现已在中国获批。同时,其也在美国、日本被批准用于成人和6岁及以上儿童和青少年的治疗。
版权声明:凡注明“来源:中国西藏网”或“中国西藏网文”的所有作品,版权归高原(北京)文化传播有限公司。任何媒体转载、摘编、引用,须注明来源中国西藏网和署著作者名,否则将追究相关法律责任。